ESTOS ELEMENTOS SE CONOCEN COMO BIOELEMENTOS:
Las
plantas, los animales y el hombre, así como todas las cosas materiales que
forman parte de nuestro mundo y el universo, están formados de materia. La materia
es todo aquello que ocupa un lugar en el espacio y que tiene masa.
A partir
de los átomos que existen en el planeta poco a poco se formó la materia viva y
con ella los sistemas vivientes. Toda la materia viva está constituida por la
combinación de elementos como (C, H, O, N, S, P) unidos con enlace covalente,
en el cual los átomos compartes pares de electrones.
El 97.90
% de la materia que forma a los seres vivos está compuesta en su mayoría por la
combinación de estos seis elementos.
PORCENTAJES DE LOS SEIS ELEMENTOS QUÍMICOS
QUE PRINCIPALMENTE FORMA LA MATERIA DE LOS SERES VIVOS
Un 2 % lo
constituye el calcio, sodio, potasio, magnesio y cloro y 0.1 % cantidades muy
pequeñas de manganeso, hierro, cobalto, cobre, zinc, boro, aluminio, vanadio,
molibdeno, yodo y silicio, entre otros.
CARACTERÍSTICAS
El átomo de carbono tiene 6 protones, 6 electrones: 2 en el primer nivel de
energía y 4 en el segundo; esto permite que el carbono pueda formar hasta 4
enlaces covalentes al unirse con otros átomos de C o de elementos distintos.
Los enlaces pueden ser sencillos, dobles o triples. Por la capacidad de formar
4 enlaces se dice que es un átomo tetravalente.
IMPORTANCIA
PARA EL SER HUMANO
El
carbono forma parte de los ciclos de la tierra, el intercambio atmosférico,
además hace parte de la respiración (CO2), etc. Es el pilar básico de la
química orgánica. Se conocen cerca de 10 millones de compuestos de carbono, y
forma parte de todos los seres vivos conocidos.
La
importancia del elemento reside en gran parte en su presencia en los seres
vivos.
Forma
parte de las moléculas orgánicas. (Biomoléculas como proteínas, carbohidratos,
lípidos, ácidos nucleicos).
Es el
átomo más sencillo, ya posee 1 protón y 1 electrón. Es el elemento más
abundante en el universo. Las estrellas están formadas por H gaseoso, la
energía del sol se debe a la conversión de H en helio. La mayor parte del
hidrógeno en la tierra se encuentra formando compuestos como el agua y las
moléculas orgánicas o biomoléculas.
IMPORTANCIA
PARA EL SER HUMANO
El
Hidrógeno: además de ser uno de los componentes de la molécula de agua,
indispensable para la vida y muy abundante en los seres vivos, forma parte de
los esqueletos de carbono de las moléculas orgánicas. Puede enlazarse con
cualquier bioelemento.
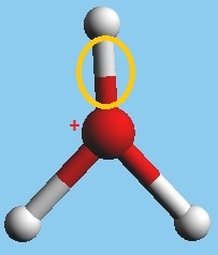
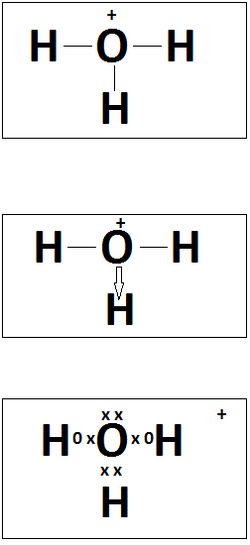
El átomo
de oxígeno tiene 8 protones y 8 electrones, 2 electrones en la primera orbita y
6 en la segunda, el oxígeno se encuentra en forma diatómica O2. Es un elemento
muy activo es decir reacciona químicamente con otros elementos.
IMPORTANCIA
PARA EL SER HUMANO
Es
utilizado en el proceso de la respiración aeróbica; o sea en la conversión de
energía por la células. El oxígeno es producto de la fotosíntesis.
NITRÓGENO Constituye el 78 % del
aire, pero este elemento no puede ser asimilado directamente por las plantas,
por lo que lo toma en forma de compuestos que si son asimilables, como los
nitratos que se encuentran en el suelo y en el agua, el amoniaco es producido
por la putrefacción de plantas y animales ; o por cierto tipo de bacterias.
IMPORTANCIA
PARA EL SER HUMANO
Forma
parte de las proteínas, ya que forma parte de todos los aminoácidos. También se
halla en las bases nitrogenadas de los ácidos nucleicos. Prácticamente todo el
nitrógeno es incorporado al mundo vivo como ion nitrato, por las plantas.
AZUFRE se encuentra en forma natural en regiones
volcánicas 0.02 %.
El azufre es un elemento químico esencial constituyente de los aminoácidos,
cisteína y metionina, que son necesarios para la síntesis de las proteínas de
los seres vivos. El azufre está presente en muchísimos productos que
utilizamos a diario en nuestra casa, en nuestro jardín, el campo y otros muchos
usos. Ejemplo de ello es que se utiliza para fabricar el ácido sulfúrico de las baterías, es un elemento
básico en la mezcla para la pólvora, también se utiliza para la elaboración del caucho, para el blanqueado
del papel o el fijador para la fotografía,
etc.; también se utiliza en fosfatos de fertilizantes,
fungicidas y como nutritivo para LAS
PLANTAS.
Estos son algunos de los usos habituales de este elemento, pero si hablamos
desde el punto de vista del ser humano, el azufre es muy importante en muchas
funciones que desempeña en el cuerpo. Ayuda a mantener el aporte necesario de
oxígeno en nuestro cerebro. También es importante desde el punto de vista
mental porque ayuda a mantener la tranquilidad en las personas a través de las
vitaminas del tipo D. También es importante para la construcción de tejidos en
el cuerpo humano ya que es una parte importante de los aminoácidos. El azufre
es esencial para el correcto funcionamiento de la insulina en el cuerpo humano.
También es necesario para la conversión de carbohidratos en energía.
FÓSFORO desempeña un
papel esencial en la transferencia de energía como lo es en el
metabolismo la formación muscular en un 0.01 %. El fósforo es un elemento esencial para los seres vivos, y los procesos de
la fotosíntesis de las plantas, como otros procesos químicos de los seres
vivos, los cuales no se pueden realizar sin ciertos compuestos en base a
fósforo.
En la naturaleza se encuentra
formando parte de los minerales o de los componentes orgánicos de los tejidos
vivos como huesos y dientes
Sin la intervención del
fósforo no es posible que un ser vivo pueda sobrevivir.
El fósforo es un elemento que
se puede encontrar en las estructuras del ADN de los organismos.
El fósforo es uno de los
elementos más importantes para los sistemas biológicos ya que forma parte de
moléculas tan importantes como los ácidos nucleicos (AND,ARN), el ATP y otros
compuestos fosforados.
Además juega un papel especial
en el metabolismo energético de los seres vivos, pues al transferirse un ión
fosfato a una molécula de ADP se origina una molécula de ATP, rica en energía
fácilmente transportable.
Hay grandes cantidades de
fósforo contenido en el organismo, sobre todo en los ácidos nucleicos ARN y
AND, y en la membrana en forma de fosfolípidos.
La biosfera ofrece varias
opciones de energía para el desarrollo y vida de organismos. Es ahí donde
aparece el fósforo.
Es necesario en la biosfera
porque aunque no es un constituyente de las proteínas, éstas no pueden formarse
sin él, ya que requieren del enlace de fosfato de alta energía en forma de ATP.
Además este elemento tiene una
gran importancia ecológica por ser probablemente el elemento limitante o
regulador de la productividad de los ecosistemas.
Es componente de los ácidos
nucleicos como el ADN, muchas sustancias intermedias en la fotosíntesis y en la
respiración celular están combinadas con el fósforo, y los átomos de fósforo
proporcionan la base para la formación de los enlaces de alto contenido de
energía del ATP, se encuentra también en los huesos y los dientes de animales,
incluyendo al ser humano.